《精修版高二化學(xué)蘇教版選修四學(xué)案:專題3 第1單元第2課時(shí) 弱電解質(zhì)的電離平衡》由會(huì)員分享,可在線閱讀�����,更多相關(guān)《精修版高二化學(xué)蘇教版選修四學(xué)案:專題3 第1單元第2課時(shí) 弱電解質(zhì)的電離平衡(2頁珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1��、 精品資料
專題三第一單元弱電解質(zhì)的電離平衡
第二課時(shí)弱電解質(zhì)的電離平衡
【學(xué)習(xí)目標(biāo)】
1.使學(xué)生理解弱電解質(zhì)的電離平衡�����;了解濃度��、溫度對(duì)電離平衡的影響��。
2.充分利用學(xué)生對(duì)化學(xué)平衡的理解建立電離平衡的概念����,培養(yǎng)學(xué)生知識(shí)遷移能力;通過實(shí)驗(yàn)探究�����、數(shù)據(jù)分析�,培養(yǎng)學(xué)生的探究能力、創(chuàng)新能力���、總結(jié)歸納能力���。
【學(xué)習(xí)過程】
一�����、弱電解質(zhì)的電離平衡
『交流與討論1』醋酸在水溶液中的電離是一個(gè)可逆過程�����,隨著電離的進(jìn)行��,CH3COOH電離成H+ 和CH3COO-的速率與H+ 和CH3COO-結(jié)合成CH3COOH的速率如何變化���?溶液中各
2、離子及分子濃度如何變化�����?
『交流與討論2』當(dāng)電離達(dá)到最大程度之后����,CH3COOH電離成H+ 和CH3COO-的速率與H+ 和CH3COO-結(jié)合成CH3COOH的速率存在什么關(guān)系����?溶液中各離子及分子的濃度是否發(fā)生變化�?
結(jié)論:
1.弱電解質(zhì)的電離平衡:在一定溫度下�,當(dāng)弱電解質(zhì)在水溶液中電離達(dá)到最大程度時(shí),弱電解質(zhì)分子 的速率與離子 的速率相等����,溶液中 的濃度都 ,達(dá)到了電離平衡狀態(tài)�����。
2試用v-t圖表示出弱電解質(zhì)電離過程中正逆反應(yīng)速率隨時(shí)間的變化關(guān)系�����。
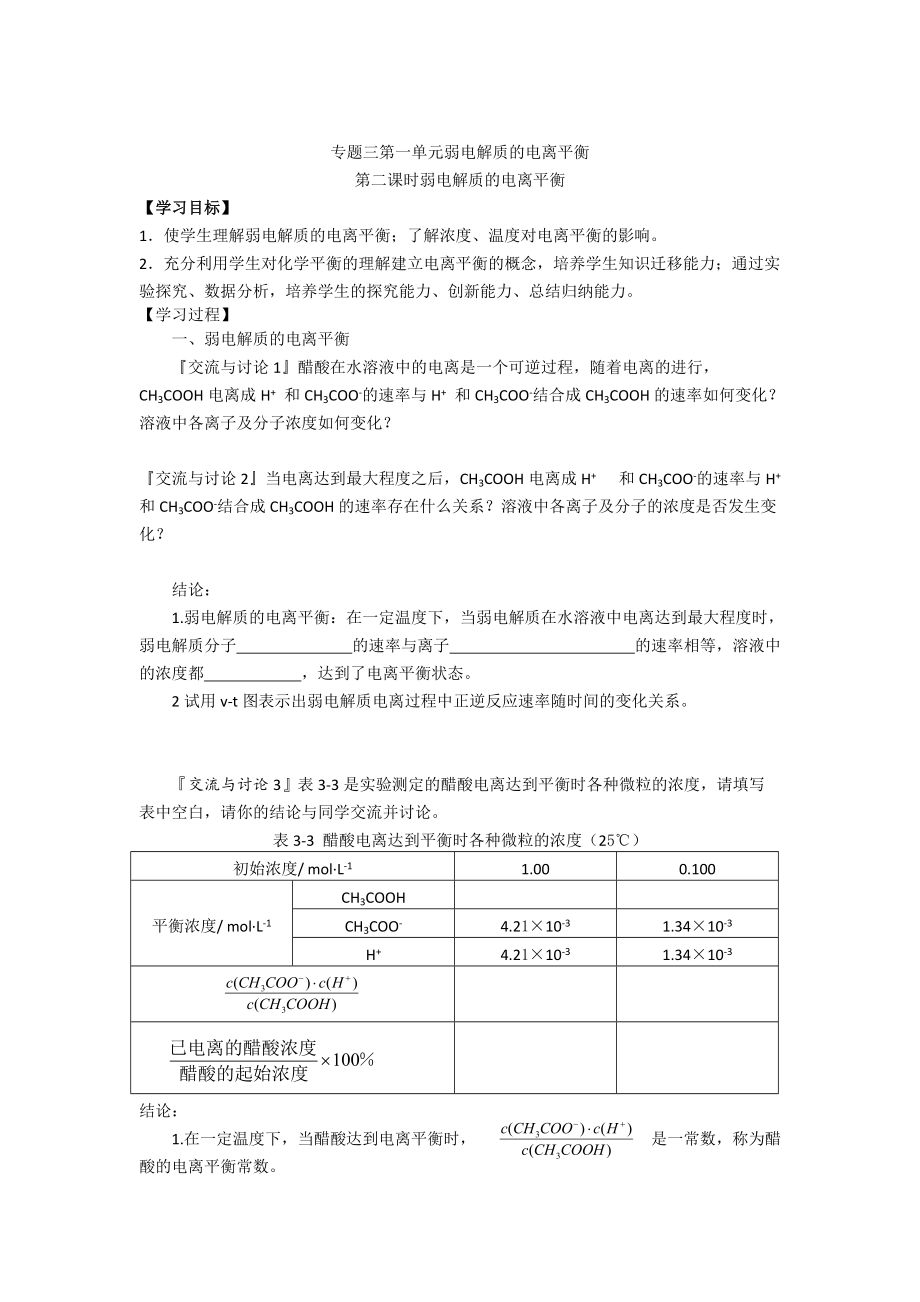
『交流與討論3』表3-3
3���、是實(shí)驗(yàn)測定的醋酸電離達(dá)到平衡時(shí)各種微粒的濃度�����,請(qǐng)?zhí)顚懕碇锌瞻?���,?qǐng)你的結(jié)論與同學(xué)交流并討論�。
表3-3 醋酸電離達(dá)到平衡時(shí)各種微粒的濃度(25℃)
初始濃度/ mol·L-1
1.00
0.100
平衡濃度/ mol·L-1
CH3COOH
CH3COO-
4.21×10-3
1.34×10-3
H+
4.21×10-3
1.34×10-3
結(jié)論:
1.在一定溫度下�,當(dāng)醋酸達(dá)到電離平衡時(shí)�, 是一常數(shù),稱為醋酸的電離平衡常數(shù)��。
2.一元弱酸和弱堿的電離平衡常數(shù)
如:CH3COOH CH3CO
4��、O— + H+ Ka= ���。
NH3·H2O NH4+ +OH— Kb= �。
注:①K越大���,離子濃度越大���,表示該弱電解質(zhì)越易電離。所以可以用Ka或Kb的大小判斷弱酸或弱堿的相對(duì)強(qiáng)弱����。
②K只與 有關(guān),不隨 改變而改變�����。
3.弱電解質(zhì)的電離度 可表示為:
注意:影響電離度的主要因素(內(nèi)因)是電解質(zhì)本身的性質(zhì)��;其外部因素(外因)主要是溶液的濃度和溫度�����。溶液越稀����,弱電解質(zhì)的電離度 ;溫度升高�,電離度 ,因?yàn)槿蹼娊赓|(zhì)的電離過程一般需要 熱量���。
『例題』乙酰水楊酸是一種一元弱酸(可用HA表示)���。在一定溫度下,0.10 mol·L-1乙酰水楊酸水溶液中�,乙酰水楊酸的電離度為5.7%,求該酸的電離常數(shù)���。
『問題解決』已知在25℃時(shí)��,1 mol·L-1氨水中NH3·H2O的電離度為0.42%�����,求NH3·H2O的電離常數(shù)��。
 精修版高二化學(xué)蘇教版選修四學(xué)案:專題3 第1單元第2課時(shí) 弱電解質(zhì)的電離平衡
精修版高二化學(xué)蘇教版選修四學(xué)案:專題3 第1單元第2課時(shí) 弱電解質(zhì)的電離平衡