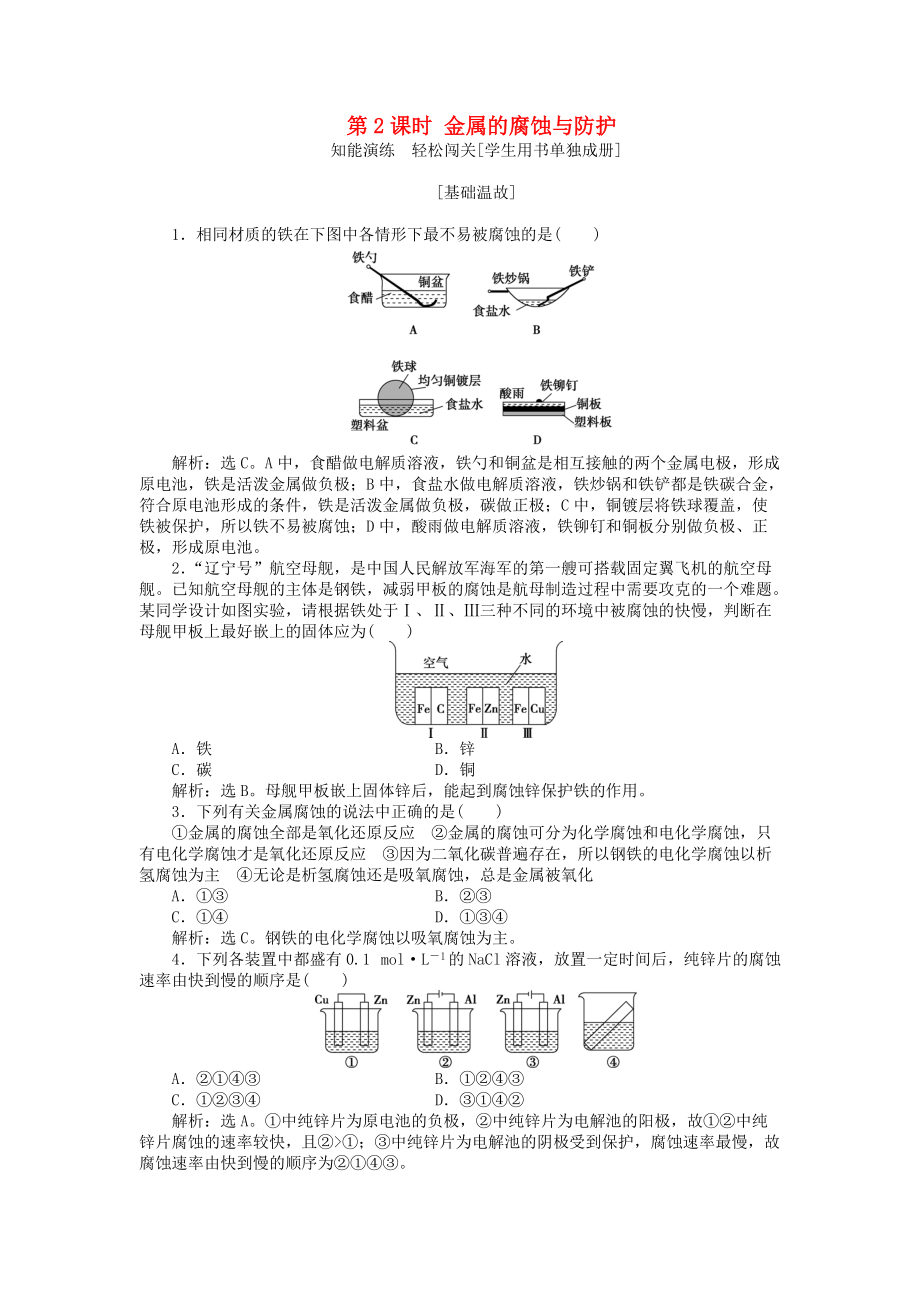
《高中化學(xué) 第1章 化學(xué)反應(yīng)與能量轉(zhuǎn)化 第3節(jié) 化學(xué)能轉(zhuǎn)化為電能——電池 第2課時(shí) 金屬的腐蝕與防護(hù)作業(yè)2 魯科版選修4》由會(huì)員分享���,可在線閱讀��,更多相關(guān)《高中化學(xué) 第1章 化學(xué)反應(yīng)與能量轉(zhuǎn)化 第3節(jié) 化學(xué)能轉(zhuǎn)化為電能——電池 第2課時(shí) 金屬的腐蝕與防護(hù)作業(yè)2 魯科版選修4(5頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索����。
1�����、
第2課時(shí) 金屬的腐蝕與防護(hù)
知能演練 輕松闖關(guān)[學(xué)生用書單獨(dú)成冊(cè)]
[基礎(chǔ)溫故]
1.相同材質(zhì)的鐵在下圖中各情形下最不易被腐蝕的是( )
解析:選C�。A中,食醋做電解質(zhì)溶液��,鐵勺和銅盆是相互接觸的兩個(gè)金屬電極���,形成原電池����,鐵是活潑金屬做負(fù)極�;B中,食鹽水做電解質(zhì)溶液,鐵炒鍋和鐵鏟都是鐵碳合金��,符合原電池形成的條件�,鐵是活潑金屬做負(fù)極,碳做正極�����;C中����,銅鍍層將鐵球覆蓋,使鐵被保護(hù)���,所以鐵不易被腐蝕����;D中�,酸雨做電解質(zhì)溶液,鐵鉚釘和銅板分別做負(fù)極�、正極,形成原電池����。
2.“遼寧號(hào)”航空母艦�����,是中國(guó)人民解放軍海軍的第一艘可搭載固定翼飛機(jī)的航空母艦。已知航空母艦的主體是鋼鐵
2��、���,減弱甲板的腐蝕是航母制造過(guò)程中需要攻克的一個(gè)難題���。某同學(xué)設(shè)計(jì)如圖實(shí)驗(yàn),請(qǐng)根據(jù)鐵處于Ⅰ��、Ⅱ���、Ⅲ三種不同的環(huán)境中被腐蝕的快慢����,判斷在母艦甲板上最好嵌上的固體應(yīng)為( )
A.鐵 B.鋅
C.碳 D.銅
解析:選B�。母艦甲板嵌上固體鋅后,能起到腐蝕鋅保護(hù)鐵的作用����。
3.下列有關(guān)金屬腐蝕的說(shuō)法中正確的是( )
①金屬的腐蝕全部是氧化還原反應(yīng)?��、诮饘俚母g可分為化學(xué)腐蝕和電化學(xué)腐蝕,只有電化學(xué)腐蝕才是氧化還原反應(yīng)?���、垡?yàn)槎趸计毡榇嬖冢凿撹F的電化學(xué)腐蝕以析氫腐蝕為主?、軣o(wú)論是析氫腐蝕還是吸氧腐蝕,總是金屬被氧化
A.①③ B.②③
C.①④ D
3�、.①③④
解析:選C。鋼鐵的電化學(xué)腐蝕以吸氧腐蝕為主���。
4.下列各裝置中都盛有0.1 molL-1的NaCl溶液����,放置一定時(shí)間后����,純鋅片的腐蝕速率由快到慢的順序是( )
A.②①④③ B.①②④③
C.①②③④ D.③①④②
解析:選A。①中純鋅片為原電池的負(fù)極����,②中純鋅片為電解池的陽(yáng)極,故①②中純鋅片腐蝕的速率較快��,且②>①;③中純鋅片為電解池的陰極受到保護(hù)��,腐蝕速率最慢�,故腐蝕速率由快到慢的順序?yàn)棰冖佗堍邸?
5.將炭粉和鐵粉均勻混合,撒入內(nèi)壁分別用氯化鈉溶液和稀醋酸溶液潤(rùn)濕過(guò)的幾支具支試管中�,并按下圖裝置好儀器���,觀察下圖���,正確的是( )
解析:選B。用氯化
4��、鈉溶液潤(rùn)濕過(guò)的具支試管中發(fā)生吸氧腐蝕����,正極反應(yīng):O2+2H2O+4e-===4OH-,負(fù)極反應(yīng):2Fe-4e-===2Fe2+���,總反應(yīng)式:2Fe+O2+2H2O===2Fe(OH)2����,具支試管內(nèi)氣體壓強(qiáng)減小�,導(dǎo)管中液柱上升�����;用稀醋酸溶液潤(rùn)濕過(guò)的具支試管中發(fā)生析氫腐蝕�,正極反應(yīng):2H++2e-===H2↑���,負(fù)極反應(yīng):Fe-2e-===Fe2+���,總反應(yīng)式:Fe+2H+===Fe2++H2↑,密封的具支試管內(nèi)氣體壓強(qiáng)增大��,導(dǎo)管中液柱下降�����。
6.糕點(diǎn)包裝中常見的脫氧劑組成為還原性鐵粉����、氯化鈉、炭粉等��,其脫氧原理與鋼鐵的吸氧腐蝕相同���。下列分析正確的是( )
A.脫氧過(guò)程是吸熱反應(yīng)���,可降低溫度�����,延長(zhǎng)
5����、糕點(diǎn)保質(zhì)期
B.脫氧過(guò)程中鐵做原電池正極��,電極反應(yīng)為Fe-3e-===Fe3+
C.脫氧過(guò)程中碳做原電池負(fù)極���,電極反應(yīng)為2H2O+O2+4e-===4OH-
D.含有1.12 g鐵粉的脫氧劑,理論上最多能吸收氧氣336 mL(標(biāo)準(zhǔn)狀況)
解析:選D����。在脫氧過(guò)程中,由鐵�、碳做電極,氯化鈉溶液做電解質(zhì)溶液形成原電池����,發(fā)生吸氧腐蝕,該過(guò)程為放熱反應(yīng)����;在脫氧過(guò)程中�����,碳做正極���,鐵做負(fù)極失電子發(fā)生氧化反應(yīng)生成Fe2+,F(xiàn)e2+最終被氧氣氧化為Fe3+�����,由電子守恒知消耗氧氣的體積(標(biāo)準(zhǔn)狀況下)V(O2)=22.4 Lmol-1(31.12 g/56 gmol-1)/4=336 mL�。
7.化學(xué)是一
6、門以實(shí)驗(yàn)為基礎(chǔ)的自然學(xué)科����,化學(xué)實(shí)驗(yàn)在化學(xué)學(xué)習(xí)中具有極其重要的作用。
(1)下列哪個(gè)裝置可防止鐵棒被腐蝕________����。
(2)在實(shí)際生產(chǎn)中,可在鐵件的表面鍍銅防止鐵被腐蝕���,裝置示意圖如下�。
①A電極對(duì)應(yīng)的金屬是________(寫名稱),B電極的電極反應(yīng)式是________________________________________________________________________��。
②若電鍍前鐵����、銅兩片金屬質(zhì)量相同,電鍍完成后將它們?nèi)〕鱿磧?����、烘干��、稱量�����,兩者質(zhì)量差為5.12 g���,則電鍍時(shí)電路中通過(guò)的電子數(shù)目為________(設(shè)NA為阿伏加德羅常數(shù)的值)。
7��、
解析:(1)B裝置����,因鐵棒做正極����,故受保護(hù)不被腐蝕�;D裝置中鐵棒做電解池的陰極,故受保護(hù)不被腐蝕�。(2)②涉及的電極反應(yīng),陽(yáng)極:Cu-2e-===Cu2+����,陰極:Cu2++2e-===Cu,設(shè)兩極原來(lái)的質(zhì)量均為m g��,陽(yáng)極溶解的銅的物質(zhì)的量為x mol���,則陰極上析出的銅的質(zhì)量為64x g���,由電鍍完成后兩者質(zhì)量差為5.12 g,即64x+64x=5.12��,則x=0.04�,故參加反應(yīng)的銅的物質(zhì)的量為0.04 mol,電路中通過(guò)的電子數(shù)目為0.08NA�。
答案:(1)BD (2)①銅 Cu2++2e-===Cu ②0.08NA
8.如圖所示,液面上浮著一個(gè)空心鐵球�。
(1)數(shù)天后可觀察
8、到的現(xiàn)象是________�。
①鐵球表面出現(xiàn)紅棕色銹斑
②鐵球表面出現(xiàn)黑色銹斑
③量筒內(nèi)水位下降
④量筒內(nèi)水位上升
A.①③ B.①④
C.②③ D.③④
(2)發(fā)生上述現(xiàn)象的原因是________________________________________
________________________________________________________________________
________________________________________________________________________
(用
9、電極反應(yīng)式及必要的文字予以說(shuō)明)���。
解析:量筒中的空氣���、溶有O2的食鹽水和鐵球(鐵碳合金)組成原電池,發(fā)生了吸氧腐蝕��。其負(fù)極反應(yīng)是2Fe-4e-===2Fe2+��,正極反應(yīng)是O2+2H2O+4e-===4OH-�。Fe2+與OH-結(jié)合成Fe(OH)2,再被O2氧化成Fe(OH)3���,F(xiàn)e(OH)3脫水成為Fe2O3xH2O而在鐵球表面出現(xiàn)紅棕色銹斑����。由于量筒中的O2被吸收��,所以量筒內(nèi)的水位會(huì)上升�。
答案:(1)B (2)鐵球發(fā)生了吸氧腐蝕。其負(fù)極反應(yīng)為2Fe-4e-===2Fe2+�,正極反應(yīng)為O2+2H2O+4e-===4OH-,總反應(yīng)為2Fe+O2+2H2O===2Fe(OH)2�����,隨后發(fā)生的反
10����、應(yīng)為4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3xH2O+(3-x)H2O
[能力提升]
9.下列與金屬腐蝕有關(guān)的說(shuō)法正確的是( )
A.圖a中���,插入海水中的鐵棒���,越靠近底端腐蝕越嚴(yán)重
B.圖b中,開關(guān)由M改置于N時(shí)��,CuZn合金的腐蝕速率減小
C.圖c中�����,接通開關(guān)時(shí)Zn腐蝕速率增大���,Zn上放出氣體的速率也增大
D.圖d中���,ZnMnO2干電池自放電腐蝕主要是由MnO2的氧化作用引起的
解析:選B���。A項(xiàng),插入海水中的鐵棒靠近液面的位置與氧氣接觸����,易發(fā)生吸氧腐蝕,而溶液內(nèi)部氧氣濃度較小�����,腐蝕較慢�,A錯(cuò)誤;B項(xiàng)���,由M改置于N后�,
11��、鋅做原電池的負(fù)極�,CuZn 合金應(yīng)充當(dāng)原電池的正極,明顯受到了一定的保護(hù)����,腐蝕速率減小,B正確��;C項(xiàng)�����,接通開關(guān)時(shí)�,鋅做原電池的負(fù)極,腐蝕速率變大�,但是氣體不在鋅上(負(fù)極)產(chǎn)生,而是在鉑上(正極)產(chǎn)生���,C錯(cuò)誤����;D項(xiàng)�����,ZnMnO2干電池發(fā)生放電反應(yīng)�,導(dǎo)致Zn被腐蝕,主要原因是鋅發(fā)生氧化反應(yīng)��,體現(xiàn)了鋅的還原性���,D錯(cuò)誤�。
10.銅板上的鐵鉚釘處的吸氧腐蝕原理如圖所示,下列有關(guān)說(shuō)法不正確的是( )
A.正極的電極反應(yīng)為2H++2e-===H2↑
B.此過(guò)程中還涉及的反應(yīng):4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此過(guò)程中銅并不被腐蝕
D.此過(guò)程中電子從Fe流向Cu
解
12�、析:選A。該圖表示吸氧腐蝕�����,其中鐵鉚釘為負(fù)極�����,電極反應(yīng)為2Fe-4e-===2Fe2+�����,銅板做正極�,電極反應(yīng)為O2+2H2O+4e-===4OH-,當(dāng)形成Fe(OH)2后����,還發(fā)生反應(yīng)4Fe(OH)2+O2+2H2O===4Fe(OH)3,故A項(xiàng)錯(cuò)誤����。
11.出土的錫青銅(銅錫合金)文物常有Cu2(OH)3Cl覆蓋在其表面�。下列說(shuō)法不正確的是( )
A.錫青銅的熔點(diǎn)比純銅低
B.在自然環(huán)境中��,錫青銅中的錫可對(duì)銅起保護(hù)作用
C.錫青銅文物在潮濕環(huán)境中的腐蝕比干燥環(huán)境中快
D.生成Cu2(OH)3Cl覆蓋物是電化學(xué)腐蝕過(guò)程���,但不是化學(xué)反應(yīng)過(guò)程
解析:選D。合金的熔點(diǎn)一般低于成分金屬的熔
13����、點(diǎn),A正確���;錫比銅活潑�����,形成原電池時(shí)做負(fù)極�����,被腐蝕�����,從而銅被保護(hù)���,B正確���;金屬在潮濕的環(huán)境中比在干燥的環(huán)境中腐蝕快,C正確����;電化學(xué)腐蝕的過(guò)程中發(fā)生原電池反應(yīng),屬于化學(xué)反應(yīng)�,D錯(cuò)誤。
12.鍍鋅鐵在發(fā)生析氫腐蝕時(shí)���,若有0.2 mol電子發(fā)生轉(zhuǎn)移�����,下列說(shuō)法正確的是( )
①有5.6 g金屬被腐蝕?��、谟?.5 g金屬被腐蝕 ③在標(biāo)準(zhǔn)狀況下有2.24 L氣體放出?���、茉跇?biāo)準(zhǔn)狀況下有1.12 L 氣體放出
A.①② B.②③
C.①④ D.③④
解析:選B。首先確定:負(fù)極反應(yīng):Zn-2e-===Zn2+,正極反應(yīng):2H++2e-===H2↑����,其次根據(jù)“0.2 mol電子發(fā)生轉(zhuǎn)移”進(jìn)行計(jì)
14、算��。
13.防止金屬的腐蝕是世界級(jí)難題�,每年全世界鋼產(chǎn)量的四分之一因腐蝕而損失���。
(1)圖甲是模擬鋼鐵腐蝕的裝置(鹽橋中裝有含瓊脂的KCl飽和溶液)�,發(fā)生的腐蝕主要是電化學(xué)中的________腐蝕�,該腐蝕過(guò)程中正極的電極反應(yīng)式為________________________________________________________________________
________________________,NaCl溶液中[Cl-]________(填“增大”�、“減小”或“不變”)。
(2)為降低某水庫(kù)鐵閘門的腐蝕速率�����,可以采用圖乙方案��,其中焊接在鐵閘門上的固體材料R可
15�、以采用________。
A.銅 B.鈉
C.鋅 D.石墨
(3)圖丙所示方案也可以降低鐵閘門的腐蝕速率�,其中鐵閘門應(yīng)連接直流電源的________極,這種防止金屬腐蝕的方法叫做____________________。
(4)鍍銅可防止鐵制品腐蝕�,電鍍時(shí)用銅而不用石墨做陽(yáng)極的原因是________________________________________________________________________
________________________________________________________________________。
解
16���、析:(1)由于是Fe與稀H2SO4的反應(yīng)�,所以是析氫腐蝕�。正極反應(yīng)為2H++2e-===H2↑。由于Fe失電子��,F(xiàn)e2+進(jìn)入NaCl溶液中���,鹽橋中Cl-會(huì)移向NaCl溶液中保持電荷平衡�,[Cl-]增大��。
(2)R活潑性應(yīng)比鐵強(qiáng)且能穩(wěn)定存在于水溶液中�,選鋅。
(3)圖丙是外加電流的陰極保護(hù)法���,鐵閘門接電源負(fù)極�。
答案:(1)析氫 2H++2e-===H2↑ 增大
(2)C
(3)負(fù) 外加電流的陰極保護(hù)法
(4)銅做陽(yáng)極可失電子轉(zhuǎn)變?yōu)镃u2+進(jìn)入溶液補(bǔ)充陰極上放電的Cu2+�����,使電鍍液中c(Cu2+)保持穩(wěn)定
14.下圖中a為生鐵,A燒杯中放入苯�,B燒杯中為1 molL-1的稀硫酸,C
17��、燒杯中為海水�。
(1)B中Pt極的電極反應(yīng)式為________________________________________________。
(2)C中Cu極的電極反應(yīng)式為________________________________________________��,
Cu極附近溶液中的pH________(填“增大”��、“減小”或“不變”)����。
(3)比較A����、B、C中鐵被腐蝕的速率���,由快到慢的順序是____________���。
(4)要使B中的鐵難被腐蝕,可將B中的稀硫酸改為____________��。
解析:(1)B中Pt極的電極反應(yīng)式為2H++2e-===H2↑。(2)C中
18�����、Cu極是正極���,發(fā)生還原反應(yīng)�,電極反應(yīng)式為2H2O+O2+4e-===4OH-�,Cu極附近溶液的pH增大。(3)由于Fe與Pt的活動(dòng)性差距比Fe與Cu大�,并
且B中為稀硫酸,故B中反應(yīng)速率快���,而A中物質(zhì)是苯����,鐵不易被腐蝕����,故腐蝕速率由快到慢的順序是B>C>A。(4)要使B中的鐵難被腐蝕�,可將B中的稀硫酸改為非電解質(zhì)溶液,如酒精�、苯��、四氯化碳等��。
答案:(1)2H++2e-===H2↑
(2)2H2O+O2+4e-===4OH- 增大
(3)B>C>A
(4)酒精(或苯����、四氯化碳等)
6EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F3756EDBC3191F2351DD815FF33D4435F375
 高中化學(xué) 第1章 化學(xué)反應(yīng)與能量轉(zhuǎn)化 第3節(jié) 化學(xué)能轉(zhuǎn)化為電能——電池 第2課時(shí) 金屬的腐蝕與防護(hù)作業(yè)2 魯科版選修4
高中化學(xué) 第1章 化學(xué)反應(yīng)與能量轉(zhuǎn)化 第3節(jié) 化學(xué)能轉(zhuǎn)化為電能——電池 第2課時(shí) 金屬的腐蝕與防護(hù)作業(yè)2 魯科版選修4