《2022年高考化學(xué)二輪專題復(fù)習(xí) 定量實驗導(dǎo)學(xué)案》由會員分享�,可在線閱讀,更多相關(guān)《2022年高考化學(xué)二輪專題復(fù)習(xí) 定量實驗導(dǎo)學(xué)案(4頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
1、2022年高考化學(xué)二輪專題復(fù)習(xí) 定量實驗導(dǎo)學(xué)案
一�����、給出數(shù)據(jù)+分析數(shù)據(jù)+發(fā)現(xiàn)規(guī)律型
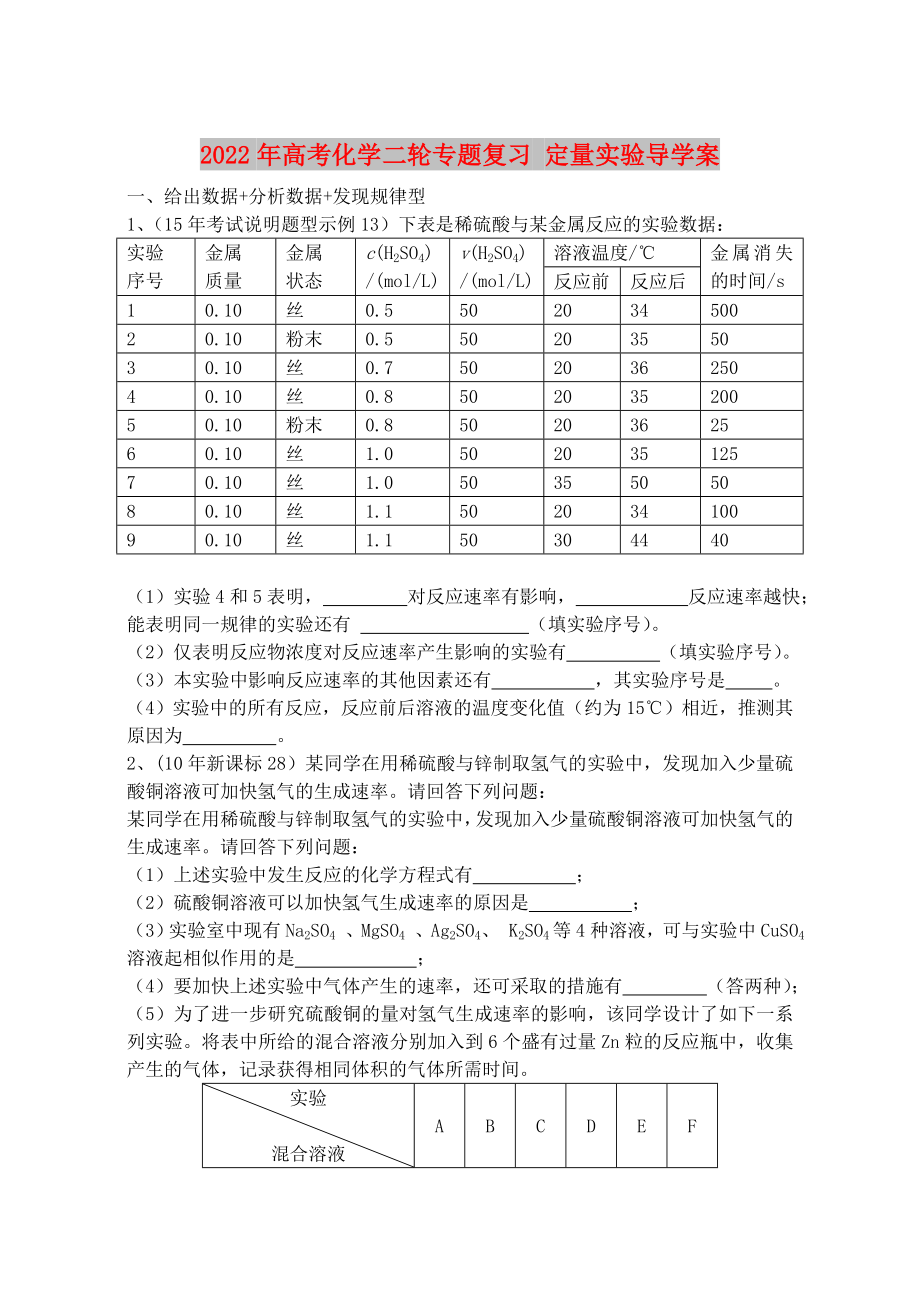
1���、(15年考試說明題型示例13)下表是稀硫酸與某金屬反應(yīng)的實驗數(shù)據(jù):
實驗
序號
金屬
質(zhì)量
金屬
狀態(tài)
c(H2SO4)
/(mol/L)
v(H2SO4)
/(mol/L)
溶液溫度/℃
金屬消失的時間/s
反應(yīng)前
反應(yīng)后
1
0.10
絲
0.5
50
20
34
500
2
0.10
粉末
0.5
50
20
35
50
3
0.10
絲
0.7
50
20
36
250
4
0.10
絲
0.8
50
20
2���、
35
200
5
0.10
粉末
0.8
50
20
36
25
6
0.10
絲
1.0
50
20
35
125
7
0.10
絲
1.0
50
35
50
50
8
0.10
絲
1.1
50
20
34
100
9
0.10
絲
1.1
50
30
44
40
(1)實驗4和5表明����, 對反應(yīng)速率有影響�����, 反應(yīng)速率越快����;能表明同一規(guī)律的實驗還有 (填實驗序號)。
(2)僅表明反應(yīng)物濃度對反應(yīng)速率產(chǎn)生影響的實驗有
3���、 (填實驗序號)��。
(3)本實驗中影響反應(yīng)速率的其他因素還有 ���,其實驗序號是 �����。
(4)實驗中的所有反應(yīng)���,反應(yīng)前后溶液的溫度變化值(約為15℃)相近����,推測其原因為 。
2�、(10年新課標(biāo)28)某同學(xué)在用稀硫酸與鋅制取氫氣的實驗中,發(fā)現(xiàn)加入少量硫酸銅溶液可加快氫氣的生成速率����。請回答下列問題:
某同學(xué)在用稀硫酸與鋅制取氫氣的實驗中,發(fā)現(xiàn)加入少量硫酸銅溶液可加快氫氣的生成速率�����。請回答下列問題:
(1)上述實驗中發(fā)生反應(yīng)的化學(xué)方程式有 ���;
(2)硫酸銅溶液可以加快氫氣生成速率的原因是 ���;
(3)實
4、驗室中現(xiàn)有Na2SO4 �����、MgSO4 �、Ag2SO4、 K2SO4等4種溶液�,可與實驗中CuSO4溶液起相似作用的是 �����;
(4)要加快上述實驗中氣體產(chǎn)生的速率�����,還可采取的措施有 (答兩種)�;
(5)為了進一步研究硫酸銅的量對氫氣生成速率的影響�����,該同學(xué)設(shè)計了如下一系列實驗�。將表中所給的混合溶液分別加入到6個盛有過量Zn粒的反應(yīng)瓶中,收集產(chǎn)生的氣體�����,記錄獲得相同體積的氣體所需時間����。
實驗
混合溶液
A
B
C
D
E
F
4 mol·L-1H2SO4/mL
30
V1
V2
V3
V4
V5
飽和CuSO4溶液/mL
5、
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
①請完成此實驗設(shè)計�����,其中:V1= ��,V6= �����,V9= ���;
③該同學(xué)最后得出的結(jié)論為:當(dāng)加入少量 溶液時����,生成氫氣的速率會大大提高�����。但當(dāng)加入的 溶液超過一定量時����,生成氫氣的速率反而會下降。請分析氫氣生成速率下降的主要原因 ���。
3����、(xx年安徽卷?28) 某酸性工業(yè)廢水中含有K2Cr2O7。光照下�����,草酸(H2C2O4)能將其中Cr2O72-轉(zhuǎn)化為Cr3+���。某課題組研究發(fā)現(xiàn)�,少量鐵明礬[Al2Fe(SO4)4·24H2O]即可對該反應(yīng)
6�����、起催化作用��。為進一步研究有關(guān)因素對該反應(yīng)速率的影響�,探究如下:
(1)在25℃下,控制光照強度���、廢水樣品初始濃度和催化劑用量相同����,調(diào)節(jié)不同的初始pH和一定濃度草酸溶液用量���,做對比實驗�����,完成以下實驗設(shè)計表(表中不要留空格)�。
二����、測量數(shù)據(jù)+處理數(shù)據(jù)+得出結(jié)論型
1、(09新課標(biāo)26)堿式碳酸銅可表示xCuCO3·yCu(OH)2·zH2O,測定堿式碳酸銅組成的方法有多種��。
(1)現(xiàn)采用氫氣還原法��,請回答如下問題:
①寫出xCuCO3·yCu(OH)2·zH2O與氫氣反應(yīng)的化學(xué)方程式 ��;
②試驗裝置用下列所有儀器連接而成�����,按氫氣流方向的連接順序是(填入儀器接口字母編號):
(a)
7��、→( )( )→( )( )→( ) ( )→( ) ( )→( ) ( )→(l)
③稱取23.9g某堿式碳酸銅樣品�,充分反應(yīng)后得到12.7g殘留物,生成4.4g二氧化碳和7.2g水����。該樣品的結(jié)晶水質(zhì)量為 g�,化學(xué)式為 ���;
(2)某同學(xué)以氮氣代替氫氣��,并用上述全部或部分儀器來測定堿式碳酸銅的組成�����,你認(rèn)為是否可行����?請說明理由��。
2��、(xx新課標(biāo)Ⅱ28)某小組以CoCl2·6H2O�、NH4Cl、H2O2��、濃氨水為原料��,在活性炭催化下�,合成了橙黃色晶體X�。為測定其組成�,進行如下實驗。
①氨的測定:精確稱取w g
8�、 X,加適量水溶解���,注入如圖所示的三頸瓶中,然后逐滴加入足量10%NaOH溶液���,通入水蒸氣�����,將樣品液中的氨全部蒸出���,用V1 mL c1 mol·L—1的鹽酸標(biāo)準(zhǔn)溶液吸收。蒸氨結(jié)束后取下接收瓶�,用c2 mol·L—1NaOH標(biāo)準(zhǔn)溶液滴定過剩的HCl,到終點時消耗V2 mL NaOH溶液��。
②氯的測定:準(zhǔn)確稱取樣品X���,配成溶液后用AgNO3標(biāo)準(zhǔn)溶液滴定���,K2CrO4溶液為指示劑�����,至出現(xiàn)淡紅色沉淀不再消失為終點(Ag2CrO4為磚紅色)����。
回答下列問題:
(1)裝置中安全管的作用原理是?????????? ����。
(2)用NaOH標(biāo)準(zhǔn)溶液滴定過剩的HCl時,應(yīng)使用??? 式滴定管�,可使用的指示劑
9、為????????? ��。
(3)樣品中氨的質(zhì)量分?jǐn)?shù)表達式為????????????? �。
(4)測定氨前應(yīng)該對裝置進行氣密性檢驗,若氣密性不好測定結(jié)果將???? (填“偏高”或“偏低”)�。
(5)測定氯的過程中,使用棕色滴定管的原因是???????????? ���;滴定終點時��,若溶液中c(Ag+)=2.0×10—5 mol·L—1�,c(CrO42—)為??????? mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)經(jīng)測定���,樣品X中鈷.氨.氯的物質(zhì)的量之比為1:6:3��,鈷的化合價為??????? �����,制備X的化學(xué)方程式為??????????????? �����;X的制備
10、過程中溫度不能過高的原因是??????????? ���。
參考答案
一��、1�����、(1)Zn+CuSO4=ZnSO4+H2↑ Zn+H2SO4=ZnSO4+H2↑
(2)CuSO4與Zn反應(yīng)產(chǎn)生的Cu與Zn形成Cu/Zn微電池�,加快了氫氣產(chǎn)生的速率
(3)Ag2SO4
(4)升高反應(yīng)溫度�、適當(dāng)增加硫酸的濃度��、增加鋅粒的比表面積等
(5)①30 10 17.5 ②灰黑 暗紅
③當(dāng)加入一定量的CuSO4后�����,生成的單質(zhì)Cu會沉積在Zn的表面�,降低了Zn與溶液的接觸面積
3�、20 20
二、
1�����、(1)① xCuCO3·yCu(
11�、OH)2·zH2O+(x+y)H2(x+y)Cu+xCO2+(x+2y+z) H2O
②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
③1.8 CuCO3·Cu(OH) 2·H2O
(2)可以 根據(jù)反應(yīng)xCuCO3·yCu(OH) 2·zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依據(jù)堿式碳酸銅���、CuO���、CO2和H2O質(zhì)量(或其中任意三個量),即可計算出其組成�。
2、(1) 當(dāng)A中壓力過大時���,安全管中液面上升����,使A瓶中壓力穩(wěn)定
(2)堿??? 酚酞(或甲基紅)
(3)?
(4)偏低
(5)防止硝酸銀見光分解
(6)+3 2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)6]Cl3+2H2O
溫度過高過氧化氫分解、氨氣逸出
 2022年高考化學(xué)二輪專題復(fù)習(xí) 定量實驗導(dǎo)學(xué)案
2022年高考化學(xué)二輪專題復(fù)習(xí) 定量實驗導(dǎo)學(xué)案