《初三化學(xué)中考知識(shí)點(diǎn)復(fù)習(xí)《鹽 化肥》》由會(huì)員分享�,可在線閱讀�,更多相關(guān)《初三化學(xué)中考知識(shí)點(diǎn)復(fù)習(xí)《鹽 化肥》(8頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�。
1��、1�、鹽的概念:由金屬陽(yáng)離子(或NH4+)和酸根陰離子組成的化合物����;或者能解離出金屬離子(或 NH4+)和酸根離子的化合物��。
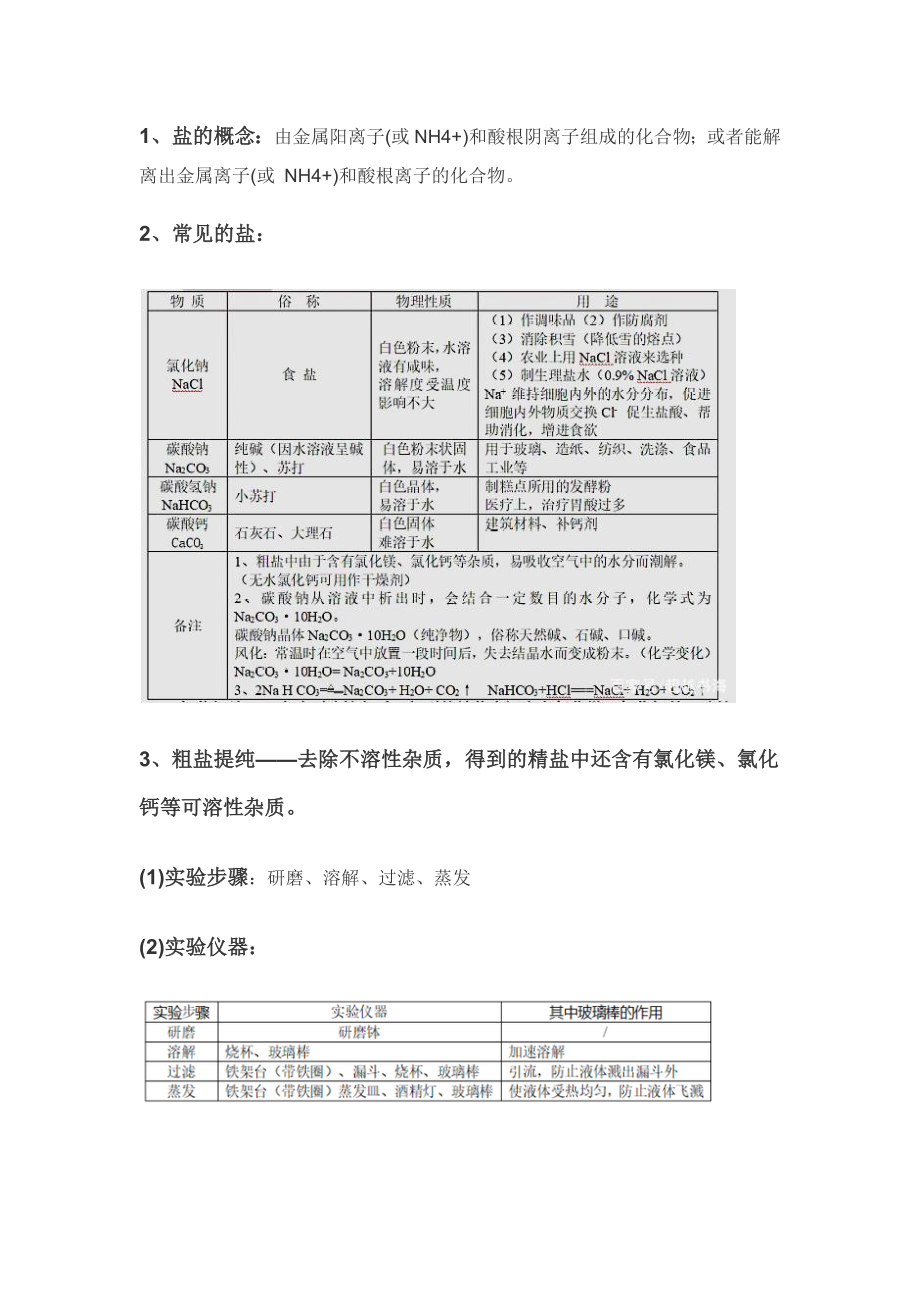
2、常見的鹽:
3、粗鹽提純——去除不溶性雜質(zhì)�,得到的精鹽中還含有氯化鎂、氯化鈣等可溶性雜質(zhì)���。
(1)實(shí)驗(yàn)步驟:研磨�、溶解��、過濾、蒸發(fā)
(2)實(shí)驗(yàn)儀器:
食鹽
碳酸鈉��、碳酸氫鈉、碳酸鈣的化學(xué)性質(zhì)
1)�����、碳酸鈣的化學(xué)性質(zhì):
①與酸的反應(yīng):2HCl + CaCO3 = CaCl2 + H2O + CO2↑
②高溫分解:CaCO3= CaO + CO2 ↑
2)�、碳酸鈉的化學(xué)性質(zhì):(這兩個(gè)反應(yīng)可用于檢驗(yàn)NaOH是否變)
(1)與酸的反應(yīng):2HC
2、l + Na2CO3 = 2NaCl + H2O + CO2↑
(2)與堿溶液的反應(yīng);Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
3)���、碳酸氫鈉的化學(xué)性質(zhì):與酸的反應(yīng)���;
HCl + NaHCO3 = NaCl + H2O + CO2↑
4)�、檢驗(yàn)溶液中存在CO32-的方法:
⑴ 取樣少許與試管中����,加入稀HCl,若有無色氣泡產(chǎn)生��,然后將該氣體通入澄清石灰水中��,石灰水變渾濁,則證明存在CO32-
2HCl + CaCO3 = CaCl2 + H2O + CO2↑ Ca(OH) 2 + CO2 = CaCO 3↓+ H2 O
⑵ 加入石灰水或Ba(OH)2溶液���,
3����、若溶液變渾濁��,然后加入稀鹽酸渾濁消失���,則存在CO32- Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 2HCl +CaCO3 = CaCl2+ H2O+CO2↑
⑶ 加入CaCl2或Ca(NO3)2溶液,若液體變渾濁��,則有存在CO32-
CaCl2+ Na2CO3= CaCO3↓+2NaCl Ca(NO3)2+ Na2CO3= CaCO3↓+2Na(NO3)2
4��、鹽的性質(zhì)
(1)鹽的溶解性
鉀鈉銨硝全可溶,碳酸鋇鈣銀不溶���;硫酸鋇和氯化銀��,不溶水來不溶酸�;
鎂鋁亞鐵和鐵銅����,五堿均不溶于水;氫氧化鈣硫酸鈣��,微溶于水要記牢�����;
(2)鹽的化學(xué)性質(zhì)
A����、 鹽(可溶)+ 金屬1
4���、 → 金屬2 + 新鹽(金屬1比金屬2活潑,K����、Ca�、Na除外)
反應(yīng)類型:置換反應(yīng)
Fe + CuSO4 == Cu + FeSO4 (“古代濕法煉銅”原理)
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
B、 鹽 + 酸 → 新鹽 + 新酸(滿足復(fù)分解反應(yīng)的條件)
反應(yīng)類型:復(fù)分解反應(yīng)
H2SO4 + BaCl2 =BaSO4 ↓+ 2HCl(注BaSO4沉淀:白色��,不溶于稀硝酸)
2HCl + Na2CO3 = 2NaCl + CO2↑+ H2O
2HCl + CaCO3 = CO2↑+ CaCl2
5��、 + H2O
HCl + NaHCO3 = H2O + NaCl +CO2↑
HCl + AgNO3 = HNO3 + AgCl↓ (注AgCl沉淀:白色,不溶于稀硝酸)
C����、 鹽 + 堿 → 新鹽 + 新堿(反應(yīng)物需都可溶�,且滿足復(fù)分解反應(yīng)的條件)
反應(yīng)類型:復(fù)分解反應(yīng)
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 現(xiàn)象:出現(xiàn)藍(lán)色沉淀
(注:CuSO4 溶液:藍(lán)色 Cu(OH)2沉淀:藍(lán)色)
3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl 現(xiàn)象:出現(xiàn)紅褐色沉淀
(注:FeCl3溶液:黃色 Fe(OH)3沉淀:紅褐色)
Ca(OH)2
6�、+ Na2CO3 = CaCO3↓ + 2NaOH 現(xiàn)象:澄清石灰水變渾濁
D����、 鹽 + 鹽 → 兩種新鹽(反應(yīng)物需都可溶�,且滿足復(fù)分解反應(yīng)的條件)
反應(yīng)類型:復(fù)分解反應(yīng)
NaCl + AgNO3 = AgCl ↓+ NaNO3 現(xiàn)象:出現(xiàn)白色沉淀
Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl 現(xiàn)象:出現(xiàn)白色沉淀
5�、復(fù)分解反應(yīng)
1�、概念:由兩種化合物互相交換成分���,生成另外兩種化合物的反應(yīng)
2��、 特點(diǎn):首尾相交換,各元素的化合價(jià)不變
3����、 條件:生成物:有沉淀或有氣體或有水生成時(shí)��,復(fù)分解反應(yīng)才可以發(fā)生.
4、反應(yīng)物:有酸酸必溶��,無酸堿鹽溶
由于初中常見的
7��、酸是可溶性的�,因此:
6����、常見離子共存與檢驗(yàn)
1、 若離子之間發(fā)生離子反應(yīng)����,離子間便不能在溶液共存:
(1)生成沉淀物:Cl-與Ag+���、 Ba2+ 與SO42-、OH-與Cu2+��、Fe3+
(2)生成氣體:OH-與NH4+ 、H+和CO32-
(3生成水
2���、此外要注意:題目要求的在酸性溶液還是堿性溶液、或者溶液是無色還是有色
常見的有色離子:Fe3+黃色�����、Fe2+淺綠色�����、Cu2+藍(lán)色��、MnO4-紫色
7�����、除雜
遵循的原則:不增�、不減、簡(jiǎn)便����、易分
1��、 物理方法:利用物質(zhì)的溶解性���、磁性、沸點(diǎn)等物理性質(zhì)的差異分離
Eg:鐵粉和碳粉 BaSO4和NaOH粉末
2 化
8��、學(xué)方法:①化氣法:像混合物中加入某種試劑�,使混合物中的雜質(zhì)變?yōu)闅怏w逸出
Eg:NaCl中混有少量Na2CO3雜質(zhì)
方法:加入HCl Na2CO3 +HCl=NaCl+H2O+CO2↑
3 沉淀法:向混合物中加入某種試劑,使該試劑與雜質(zhì)放映轉(zhuǎn)化成沉淀���,再經(jīng)過慮除掉沉淀��,以除雜質(zhì)
Eg:NaCl中混有少量NaSO4雜質(zhì)
方法:加入BaCl�����,過濾除去雜質(zhì) NaSO4=BaSO4+NaCl
4����、加熱高溫法:熱高溫混合物是雜質(zhì)變?yōu)闅怏w除去
Eg:CaO中混有CaCO3雜質(zhì)
方法:高溫加熱 CaCO3=CaO + CO2 ↑
5、溶解法:向混合物中加入某種試劑���,使雜質(zhì)與試劑反應(yīng)而被溶解掉
9���、����,以除去雜質(zhì)
Eg:Cu中混有少量CuO雜質(zhì)
方法:加入稀HCl,再經(jīng)過過濾而除去 CuO+HCl=CuCl2+ H2O
6. 置換法:向混合物中加入一種單質(zhì)���,是單質(zhì)與雜質(zhì)反應(yīng)��,而被除去
Eg:FeSO4中混有少量CuSO4雜質(zhì)
方法:向其加入足量的鐵粉 Fe+ CuSO4=Cu+FeSO4
7���、吸收法:將氣體混合物通過洗氣裝置��,雜質(zhì)被洗氣裝置的試劑吸收而除去
Eg:CO中混有少量CO2
方法:將混合氣體通過盛有足量的NaOH溶液的洗氣置 2NaOH+CO2=Na2CO3+H2O
8����、化肥
一、農(nóng)家肥料:營(yíng)養(yǎng)元素含量少���,肥效慢而持久�、價(jià)廉、能改良土壤結(jié)構(gòu)
二���、化學(xué)肥料:(氮肥����、鉀肥���、磷肥)
1�����、氮肥 (1)����、作用:促進(jìn)植物莖���、葉生長(zhǎng)茂盛、葉色濃綠(促葉)�。
(2)��、缺氮:葉黃
(3)、常用氮肥:
(4)��、生物固氮:豆科植物的根瘤菌將氮?dú)廪D(zhuǎn)化為含氮的化合物而吸收
2���、鉀肥 :(1)作用:促使作物生長(zhǎng)健壯����、莖桿粗硬�����,抗倒伏(壯稈)。
(2)缺鉀:葉尖發(fā)黃
(3)氮�、磷、鉀三種化肥的區(qū)別方法
6����、 化肥與環(huán)境
(1)土壤污染:重金屬元素����、有毒有機(jī)物����、放射性物質(zhì)
(2)大氣污染:NO2��、NH3�����、H2S����、 SO2
(3)引起水體污染 :N、P過多��,導(dǎo)致水體富營(yíng)養(yǎng)化�,赤潮��、水華等現(xiàn)象
 初三化學(xué)中考知識(shí)點(diǎn)復(fù)習(xí)《鹽 化肥》
初三化學(xué)中考知識(shí)點(diǎn)復(fù)習(xí)《鹽 化肥》